統計解析計画書 (Statistical Analysis Plan; SAP) を作成する

- アウトライン
-
はじめに
統計解析計画書 (Statistical Analysis Plan; SAP) は、臨床試験プロトコルに記載された解析方針を、より技術的かつ詳細に記述した文書です。主要評価項目、副次評価項目、その他のデータに対する統計解析をどのように実行するかを、事前に明確に定める重要な役割を担います。
SAPの作成と運用には、以下のような意義があります:
| 品質の確保・・・ | 詳細に解析計画を示すことで品質の確保につながります。 |
| 流動的な計画変更・・・ |
想定外のデータ分布や欠損の発生に対して、適切に見直し・対応が可能です。 たとえば欠損処理法や感度分析の方針を追加検討する場合も、SAPの修正・追記を通じて柔軟に対応できます。 |
| 解析の再現性の担保・・・ |
変数の取り扱い、統計手法、モデル設定などを明示することで、他の統計担当者が同じ解析結果を得られるようになります。 これは透明性の確保と信頼性の担保にもつながります。 |
このようにSAPは、単なる手続き書ではなく、臨床試験の信頼性と品質を担保するための中核的な文書です。本稿では、SAPの重要性を実務の視点から紐解き、作成時に注意すべきポイントについても触れていきます。
SAPを導入する
2.1 ヒト臨床試験 (ヒト試験) の流れとSAPの関り
SAPは、ヒト臨床試験における解析の質と透明性を確保するための重要な文書です。ここでは、ヒト臨床試験におけるSAP導入の一例をご紹介します。
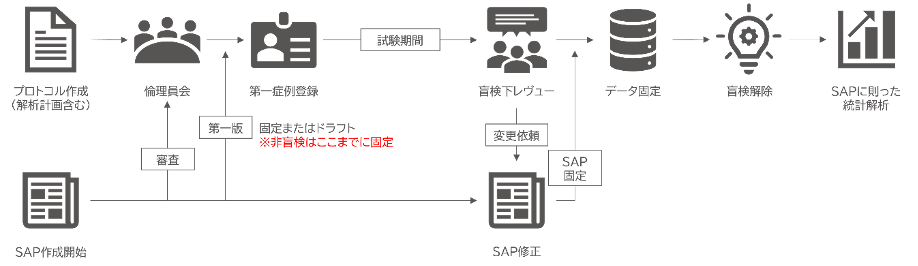
まず、SAPはプロトコルと同様に倫理審査委員会 (IRB/IEC) の審査対象となり、第一症例登録までに第1版を策定します。この段階では「ドラフト」としての提出も可能ですが、非盲検試験の場合はバイアスを防ぐため、第一症例登録までに内容を確定 (固定) することが推奨されます。
試験期間中、一定数のデータが蓄積された段階で盲検下レビュー (Blind Review) を実施し、必要に応じてSAPの修正を行います。このレビューを経てSAPを最終固定し、その後、データロック→盲検解除→統計解析の流れに入ります。
解析計画の変更が必要となった場合は、以下のように対応します:
- 主要な変更 (主要評価項目、主解析方法の変更など): プロトコルとSAPの両方を改訂
- 軽微な変更 (補助変数の追加、サブグループ定義の見直しなど): SAPのみを改訂
これらの前提条件の一部を変えるだけで、必要な症例数は大きく変化します。特に目標差の設定には注意が必要で、差が小さいほど、必要な症例数は急増します。
2.2 盲検下レビューによる変更対応
盲検下レビューでは、以下のような項目について評価・点検が行われます:
- 解析対象集団 (FAS、PPSなど) の妥当性確認
- 欠測値や外れ値の扱い方の検討
- 被験者の適格基準違反の有無
- 多施設試験における施設定義の再確認
- その他、実際のデータに即した見直しが必要な項目
このような検討を通じて、最終的な解析が妥当で再現性の高いものとなるよう調整します。なお、SAPの固定は「データ固定前かつ盲検解除前」までに完了しておく必要があります。
SAPを作成する
SAPの作成にあたっては、特段の公式な様式は存在しませんが、JAMA誌に掲載された以下の文献が実務でよく参照されます:
Gamble C, Krishan A, Stocken D, Lewis S, Juszczak E, Doré C, Williamson PR, Altman DG, Montgomery A, Lim P, Berlin J, Senn S, Day S, Barbachano Y, Loder E. Guidelines for the Content of Statistical Analysis Plans in Clinical Trials. JAMA. 2017; 318 (23): 2337-43. (PMID: 29260229)
このガイドラインは、CONSORT声明と同様にチェックリスト形式で記載されており、項目を1つずつ確認しながらSAPを作成できるようになっています。
ガイドラインでは、SAPを6つの主要セクションに分類しています。これらの内容を説明していきます。
3.1 Section 1: 管理情報 [Administrative information]
| Section/Item | Index | Description |
|---|---|---|
| タイトルと試験登録 | 1a | プロトコルに合致した記述的なタイトルで、「Statistical analysis plan」が前段または副段にあり、試験の英文要約がある(該当する場合)。 |
| 1b | 試験登録番号 | |
| SAP バージョン | 2a | 日付付きの SAP バージョン情報 |
| プロトコルバージョン | 3 | 使用しているプロトコルのバージョンへの参照 |
| SAP の改訂 | 4a | SAP の改訂履歴 |
| 4b | 各 SAP 改訂の正当性 | |
| SAP 改訂のタイミング | 4c | 中間解析などに関連した SAP 改訂のタイミング |
| 役割と責任 | 5 | SAP コントリビューターの名前、所属、役割 |
| 署名 | 6a | SAP を書く人の署名 |
| 6b | 責任ある統括統計家の署名 | |
| 6c | 治験責任医師/臨床責任者の署名 |
3.2 Section 2: はじめに [Introduction]
| Section/Item | Index | Description |
|---|---|---|
| 背景と理論的根拠 | 7 | 研究課題の簡単な説明と試験実施の簡単な正当性を含む、試験の背景と理論的根拠の概要試験を実施する簡単な理由 |
| 目的 | 8 | 具体的な目的や仮説の記述 |
3.3 Section 3: 試験方法 [Study Methods]
| Section/Item | Index | Description |
|---|---|---|
| 試験デザイン | 9 | 試験デザインの簡単な説明:試験のタイプ(例:並行群、マルチアーム、クロスオーバー、要因)、割付比率、介入の簡単な説明を含む |
| 無作為化 / ランダム化 | 10 | 無作為化の詳細(動物を割り当て(最小化など)や層別に行われたかどうかなど)(使用された層別因子や、SAP 内に保持されていない場合はその情報の場所を含む) |
| サンプルサイズ | 11 | サンプルサイズ計算の完全な詳細、またはプロトコルでのサンプルサイズ計算の参照(SAP での複製の代わりに) |
| フレームワーク | 12 | 優越性、非劣性、非劣後性などの仮説枠組みと、それに基づいてどのような比較を検定するか |
| 統計的中間解析と中止ガイダンス | 13a | 中間解析に関する情報:どのような中間解析が行われるのか、時点の一覧を示す |
| 13b | 中間解析による有意水準の調節的な考慮 | |
| 13c | 試験を早期に中止するためのガイドラインの詳細 | |
| 最終解析の時期 | 14 | 最終的な解析のタイミング 例:全ての被験者による分析、または画計された追跡期間によって層別されたタイミング |
| アウトカム評価の時期 | 15 | 成果を測定する時点(訪問 "ウィンドウ" を含む) |
3.4 Section 4: 統計的原理 [Statistical Principals]
| Section/Item | Index | Description |
|---|---|---|
| 信頼区間と p 値 | 16 | 統計的有意水準 |
| 17 | 計画されている多重度の調整についての説明。調整する場合には第1種エラーをどのように制御するかを含む | |
| 18 | 報告されるべき信頼区間(CI) | |
| アドヒアランスとプロトコルの逸脱 | 19a | 介入へのアドヒアランスの定義と測定の根拠を含めた評価の方法 |
| 19b | 介入へのアドヒアランスがどのように提示されるかについての説明 | |
| 19c | 試験のプロトコル逸脱の定義 | |
| 19d | プロトコルの逸脱がどのように要約されるかの説明(逸脱が大きい/小さいか、分析結果への影響、プロトコル逸脱を要約するためのアプローチ(例:グループごとのプロトコルの逸脱の数と種類)などの詳細を含むことができる) | |
| 解析対象集団 | 20 | 解析集団の定義例:ITT(intention-to-treat)、per-protocol、complete case、safety |
3.5 Section 5: 母集団 [Trial Population]
| Section/Item | Index | Description |
|---|---|---|
| スクリーニングデータ | 21 | 試験サンプルの代表性を示すスクリーニングデータ(収集されている場合)の報告 |
| 適格性 | 22 | 資格基準の概要 |
| 募集 | 23 | CONSORT のフロー図に含まれるべき情報 |
| 脱落/フォローアップ | 24a | 介入および/またはフォローアップからの撤退のレベル |
| 24b | フォローアップデータの回収/喪失のタイミング | |
| 24c | 離脱/追跡調査不能のデータをどのように提示するかの理由と詳細 | |
| ベースライン特性 | 25a | 要約されるベースライン特性のリスト |
| 25b | ベースラインの特性がどのように記述的に要約されるか | |
| アウトカムの定義 | 26a | 結果と時期の指定 |
| 26b | 具体的な測定方法と単位(例:グルコースコントロール hbA1c(mmol/mol 又は%)) | |
| 26c | 結果を得るために使用した計算又は変換(例:ベースラインからの変化、生活の質(QoL)スコア、イベント発生までの時間、効率等) |
3.6 Section 6: 解析 [Analysis]
| Section/Item | Index | Description |
|---|---|---|
| 解析方法 | 27a | どのような解析方法を用いて、治療効果をどのように示すのか |
| 27b | 共変量の調整の詳細を含む、各主要及び副次的な結果の一覧と説明 Any adjustment for covariates |
|
| 27c | 主要及び副次的な結果を一覧にして説明し、以下の詳細を含む:統計的手法の前提条件を確認するために使用した方法 | |
| 27d | 主要及び副次的な結果をリストアップし、以下の詳細を含む説明を行う:分布の仮定(例:正規性、比例ハザードなど)が成り立たない場合に使用する代替法 | |
| 27e | 主要及び副次的な結果をリストアップし、以下の詳細を含む説明:各結果について計画されていた感度分析 | |
| 27f | 主要及び副次的な結果を記載し、以下の詳細を含む:各結果について計画されているサブグループ分析 | |
| 欠測データ | 28 | 欠測データ・対象データを扱うための割合と仮定/統計的手法(多重反復処理など) |
| 追加解析 | 29 | 必要な追加統計解析の詳細(例:CACE(Complier-average causal effect)解析) |
| 害 | 30 | 有害性の要約に関する十分な詳細情報(例:重度、頻度、将来性、因果関係に関する情報、AEのコード化又は分類方法の詳細、有害事象(AE)データの分析方法(例:グレード3/4のみに、発生頻度分析、介入出現分析)) |
| 統計ソフトウェア | 31 | 分析に使用する統計パッケージの詳細(オプション) |
| 参考文献 | 32a | 非常に珍しい解析手法のために提供される文献などの参照 |
| 32b | データマネジメント文書 | |
| 32c | トライアルマスターファイル又は試験マスターファイルへの参照 | |
| 32d | 他の標準作業手順又は文書の参照 |
まとめ
- SAPの導入は、統計解析の品質向上に大きく貢献します。
- 盲検化の有無によって、SAPの固定時期は異なるため、設計時に注意が必要です。
- JAMAで公開されたガイドラインを活用すれば、必要な要素を網羅的に確認できます。
- SAPとプロトコルは相互に補完しあう関係であり、内容の整合性が求められます。
今回、SAPの導入と作成方法をまとめました。記載内容の詳細までは述べることはできませんでしたが、気になる方は是非問い合わせください。
